CDMO(계약 개발 제조기관)
**CDMO(계약 개발 제조 기관)의 정의와 전 인류적 역할**

CDMO(Contract Development and Manufacturing Organization)는 의약품 및 바이오의약품의 **개발부터 대량 생산까지를 통합적으로 지원하는 전문 조직**입니다[1][3][5]. 신약 개발의 복잡성과 규제 강화로 인해 제약사 및 바이오기업들이 자체적으로 모든 과정을 수행하기 어려워지면서, CDMO는 **비용 절감, 기술 전문성, 규제 준수** 측면에서 핵심 파트너로 부상했습니다[1][5].

창설 동기와 발전 과정

1. **출현 배경**: 2000년대 초반, 신약 개발 비용 급증 및 글로벌 규제 강화로 **아웃소싱 수요 증가**[1][5].
2. **역할 진화**: 기존 CMO(위탁생산기관)에서 개발(Development) 기능을 추가해 **CDMO로 재정의**[3][4].
3. **바이오의약품 확산**: 항체치료제, 세포·유전자 치료제 등 복잡한 생물학적 제제의 등장으로 **전문화된 CDMO 필요성 대두**[4][5].
CDMO(계약 개발 제조 기관)가 제공하는 서비스에 대해 설명드리겠습니다.
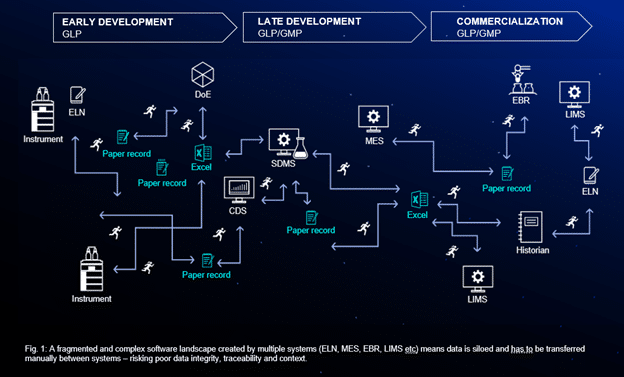
CDMO제공 서비스의 종류
CDMO는 **의약품의 개발부터 생산까지**를 포함하는 다양한 서비스를 제공합니다. 주요 서비스는 다음과 같습니다:
- **위탁 개발 서비스 (CDO)**:
- **세포주 및 공정 개발**: 바이오의약품 제작에 필요한 세포주 개발과 공정 최적화 지원[1].
- **제형 개발**: 의약품의 형태를 결정하는 제형 개발, 예를 들어 정제, 사화에스프레이 같은 형태[1][3].
- **위탁 제조 서비스 (CMO)**:
- **원료의약품(API) 및 중간체 제조**: 의약품의 기본 물질 및 중간 제품 제작[1][3].
- **완제 의약품(FDF) 제조**: 최종 사용자에게 제공될 수 있는 형태의 의약품 제조[1].
- **포장**: 의약품의 안전하고 효율적인 포장[1].
- **임상 및 상업 생산 지원**:
- **임상시험용 의약품 생산**: 임상시험 진행을 위한 의약품 제공[1][3].
- **GMP 기준의 품질 관리**: 의약품 생산 시절 합 格을 위한 품질 관리 서비스[1].
- **대규모 상업적 생산**: 시장에 출시되는 의약품 대량 생산[1].
CDMO의 역할과 비전

CDMO는 제약사나 바이오기업들이 자체 인프라 없이도 신약 개발을 진행할 수 있도록 **비용 효율성을 높이고, 기술 및 규제 준수**를 보장하는 역할을 합니다[3]. 미래에는 **연속 제조 기술**이나 **지속 가능한 생산 공정** 등 최신 기술을 도입하여 더 나은 서비스를 제공하고자 합니다[5].
이러한 서비스와 역할을 통해 CDMO는 전 세계적으로 의약품 개발 및 생산의 중요한 파트너로 자리매김하고 있습니다.
CDMO가 제공하는 주요 제품 및 치료제
CDMO는 다양한 형태의 의약품 및 치료제를 지원합니다.
- **바이오시밀러**: 원본 의약품 특허 만료 후 고품질 복제약[4].
- **세포·유전자 치료제**: CAR-T 치료제 등 개인 맞춤형 의약품[4].
- **mRNA 백신**: 차세대 백신 플랫폼을 지원하는 기술[참고: 제공된 자료 외 일반적 사실].

이 외에도 CDMO는 중소 바이오벤처의 사업을 촉진하는 데 크게 기여하고 있으며, 글로벌 건강 위기 상황에서도 중요한 역할을 했습니다[2][3].

결론
CDMO는 의약품 개발과 생산의 모든 단계를 지원하며, 이를 통해 제약 산업의 효율성과 혁신을 극대화하는 중요한 역할을 하고 있습니다. 앞으로도 CDMO는 최신 기술을 도입하고 지속 가능한 방식으로 의약품을 제공함으로써 전 세계에 더욱 큰 영향을 미칠 것으로 기대됩니다.
출처 :
[1] https://blog.naver.com/kpbma1026/222388273641
[2] https://astarnj94.tistory.com/entry/%EA%B5%AD%EB%82%B4%EC%99%B8-CDMO-%EC%84%9C%EB%B9%84%EC%8A%A4%EB%A5%BC-%EC%A0%9C%EA%B3%B5%ED%95%98%EB%8A%94-%EA%B8%B0%EC%97%85-%EC%95%8C%EC%95%84%EB%B3%B4%EA%B8%B0-1%ED%8E%B8-%ED%95%B4%EC%99%B8%ED%8E%B8
[3] http://money2.daishin.com/PDF/Out/intranet_data/Product/ResearchCenter/Report/2024/10/51525_In_depth_CDMO_v0.21_FINAL55.pdf
[4] https://astarnj94.tistory.com/entry/%EA%B5%AD%EB%82%B4%EC%99%B8-CDMO-%EC%84%9C%EB%B9%84%EC%8A%A4%EB%A5%BC-%EC%A0%9C%EA%B3%B5%ED%95%98%EB%8A%94-%EA%B8%B0%EC%97%85-%EC%95%8C%EC%95%84%EB%B3%B4%EA%B8%B0-2%ED%8E%B8-%EA%B5%AD%EB%82%B4%ED%8E%B8
[5] https://jerry-stories.tistory.com/entry/CRO-CMO-CDMO-%EC%82%B0%EC%97%85%EC%97%90-%EB%8C%80%ED%95%98%EC%97%AC
전 인류적 기여

- **신속한 약물 공급**: 임상시험용 샘플 제조부터 상업적 생산까지 **개발 기간 단축**[1][5].
- **글로벌 건강 위기 대응**: COVID-19 백신 생산에서 CDMO의 **대규모 역량이 핵심 역할 수행** (참고: 제시된 자료 외 일반적 사실).
- **중소기업 지원**: R&D 역량은 있으나 생산 인프라가 부족한 **바이오벤처의 사업화 촉진**[2][4].

비전과 미래 방향
1. **테크놀로지 혁신**: 연속제조(Continuous Manufacturing), 인공지능 기반 품질관리 도입[5].
2. **글로벌 네트워크 확장**: 아시아·유럽·북미 간 **분업 체계 구축**을 통한 효율성 극대화.
3. **지속가능성**: 친환경 공정 개발 및 에너지 소비 최적화 기술 도입.

대표적 개발 제품 및 치료제 유형
1. **바이오시밀러**: 원본 의약품 특허 만료 후 **고품질 복제약 생산**[4][5].
2. **세포·유전자 치료제**: CAR-T 치료제 등 **개인맞춤형 의약품 제조**[4].
3. **mRNA 백신**: 냉장 보관이 가능한 **차세대 백신 플랫폼 지원**.
핵심 서비스 유형
| 구분 | 세부 내용
원료의약품(API) | 생물반응기 활용 대규모 단백질 생산[4]
완제의약품 | 무균 충전·동결건조 등 최종 제형 완성[4][5]
분석 지원 | 품질규격서(QC/QA) 작성 및 안정성 시험[1]
**의약품 생산 과정**은 크게 **합성의약품**과 **바이오의약품**으로 구분됩니다. 각 유형별 공정의 차이를 포함해 단계별로 설명드리겠습니다.

1. **합성의약품 생산 과정**
(예: 알약, 캡슐)
- **혼합**: 활성성분과 부형제를 균일하게 배합[1].
- **건조**: 수분을 제거해 분말 형태로 가공[1].
- **정립**: 분말을 일정 크기의 입자로 성형[1].
- **타정**: 알약 형태로 압축 성형(타정기 사용)[1].
- **코팅**: 위장 보호 또는 서방출을 위한 막 처리[1].
- **포장**: 무균 환경에서 최종 포장[1][2].
**특징**: 기계적 공정이 주를 이루며, 대량 생산에 최적화된 구조입니다[1].

2. **바이오의약품 생산 과정**
(예: 항체치료제, 백신)
- **세포배양**: 유전자 변형 세포를 배양해 표적 단백질 생산[1][3].
- **수확**: 배양액에서 원하는 단백질 분리[3].
- **정제**: 크로마토그래피 등으로 불순물 제거[3][4].
- **여과**: 미생물 및 미세 입자 제거를 위한 멤브레인 필터링[3].
- **제품화**: 동결건조 또는 액상 형태로 최종 제형 완성[1][3].
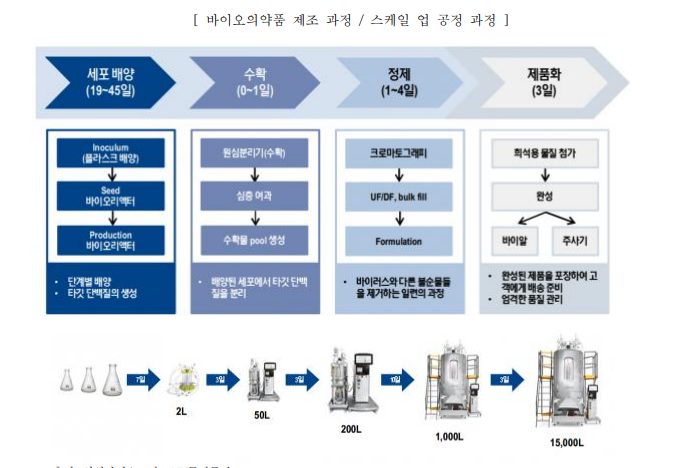
**중요 기술**: 삼성바이오로직스에서는 **단일회용 생물반응기**를 활용해 교차 오염 위험을 최소화합니다[3].

3. **품질관리 핵심 요소**
- **GMP(우수의약품제조관리기준)**: 모든 공정에서 엄격한 위생 관리[1][2].
- **안정성 시험**: 유통 기간 동안 효능 유지 여부 검증[4].
- **분석검증**: HPLC·질량분석기로 활성성분 농도 측정[2][4].
4. **신약 개발과의 연계성**
의약품 생산은 신약 개발 단계(**전임상→임상시험→승인**)와 직결됩니다[4]:
- **임상 1~3상**: 각 단계별로 생산 규모 확대(소규모→상업용)[4].
- **공정확인(Validation)**: 동일 품질의 일관성 입증이 필수[2][4].
5. **최신 기술 동향**
- **연속제조(Continuous Manufacturing)**: 공정 간 단계별 중단 없이 실시간 품질 모니터링[2].
- **개인맞춤형 제조**: CAR-T 치료제 등 환자별 특화 공정 도입[3][4].
이처럼 의약품 생산은 복잡한 공정과 철저한 품질 관리를 통해 **안전성·유효성**을 확보하는 절차로 이루어집니다. 추가적으로 궁금하신 내용이 있다면 자세히 설명드리겠습니다.
출처 :
[1] https://www.youtube.com/watch?v=x7uQT8LdjwQ
[2] https://www.khidi.or.kr/board/view?pageNum=31&rowCnt=10&no1=&linkId=26603305&menuId=MENU01847&maxIndex=00266030699998&minIndex=00266029699998&schType=0&schText=&schStartDate=&schEndDate=&boardStyle=&categoryId=&continent=&country=
[3] https://www.youtube.com/watch?v=1T_iQIUXYLc
[4] https://blog.naver.com/k2088910/222292767721
[5] http://www.theonecos.com/News/?bmode=view&idx=51728377
결론
CDMO는 단순히 위탁 생산을 넘어 **의약품 생태계의 혁신적 인프라**로 자리매김했습니다. 신속성·유연성·규모 경제를 통해 **전 세계 환자에게 효과적이고 저렴한 치료제를 공급**하는 데 핵심 역할을 수행할 것으로 기대됩니다. 특히, **개인맞춤형 의료 시대**가 본격화되면 CDMO의 중요성은 더욱 확대될 전망입니다[5].
출처 :
[1] https://adragos-pharma.com/ko/cdmo-what-is-it-and-how-it-benefits-your-business/
[2] https://blog.naver.com/kpbma1026/222388273641
[3] https://newsroom.daewoong.co.kr/archives/9948
[4] https://jerry-stories.tistory.com/entry/CRO-CMO-CDMO-%EC%82%B0%EC%97%85%EC%97%90-%EB%8C%80%ED%95%98%EC%97%AC
[5] https://moongyi2.tistory.com/entry/CDMO-%EC%82%B0%EC%97%85%EC%97%90-%EB%8C%80%ED%95%B4-%EC%9D%B4%ED%95%B4%ED%95%98%EA%B8%B0